Zadanie
Kvík si skladuje rôzne chemikálie na nie úplne bezpečných miestach, napríklad fľašu kyseliny sírovej na poličke nad posteľou. Kvapalné a pevné látky sa skladujú pomerne ľahko, potreboval však vymyslieť aj to, kde uschová svoj plyn. Zostrojil si izolovanú krabicu rozdelenú prepážkou na dve rovnako veľké časti. Do jednej časti krabice napumpoval svoj plyn o známom tlaku a teplote, v druhej časti si Kvík spravil vákuum, aby tam mohol uskladniť druhý plyn, keď nejaký bude mať. Stala sa však nehoda a Kvíkovi sa podarilo spraviť do prepážky dieru. Aká je teplota a tlak plynu po ustálení tejto sústavy?
Pri riešení tejto úlohy je veľmi vhodné predstaviť si, čo sa deje s plynom na úrovni jednotlivých častíc plynu, čím sa šikovne vyhneme skoro akémukoľvek riešeniu rovníc a pomôže nám to získať malý nadhľad. Pustime sa teda do práce.
Najprv sa zamyslime, kedy je plyn v krabici ustálený. To bude vtedy, keď v obidvoch častiach krabice, rozdelenej prepážkou, bude rovnaký tlak aj teplota. Ak by v oboch častiach krabice nebol rovnaký tlak, cez dieru v prepážke by prechádzalo z časti s väčším tlakom do časti s nižším tlakom viac častíc ako smerom naopak. A to až do času, keď by v oboch častiach krabice bol rovnaký tlak. Podobne ak by v obidvoch častiach krabice nemali častice rovnakú teplotu (t. j. rovnakú priemernú energiu), pri zrážkach v blízkosti prepážky by častice plynu prichádzajúce z časti s väčšou teplotou odovzdávali v priemere viac energie časticiam plynu prichádzajúcich z časti s nižšou teplotou. Touto jednoduchou úvahou sme teda prišli na to, že z makroskopického pohľadu musia byť v ustálenom stave1 obe veličiny, teplota a tlak plynu, rovnaké vo všetkých jeho častiach.
Ak skúmame plyn ako celok, jediné, čo zo zadania vieme zatiaľ povedať je to, že počas procesu sa objem plynu zdvojnásobí a počet častíc nezmení. Keďže Kvíkova krabica je dokonale izolovaná, taktiež vieme, že žiadne teplo nemôže vstúpiť ani odísť cez steny krabice do okolia. Inak povedané, celková vnútorná energia plynu je konštantná. Plní energie sa teda skúsme najprv pozrieť na to, či dej v zadaní nie je príkladom nejakého deja, o ktorom sme sa učili v škole (izotermický, adiabatický, izochorický či izobarický).
Prečo to nie je nič z toho, čo sme sa už učili?
Keďže počas deja sa mení objem plynu2 zjavne nemôže ísť o príklad izochorického procesu. Taktiež vieme, že počas deja sa cez steny krabice nepríjma ani neodovzdáva žiadne teplo, takže nemôže ísť ani o príklad izotermického a izobarického procesu. Pri izotermickom procese totiž plyn koná prácu na úkor prijímaného tepla, pri izobarickom dokonca aj na úkor prípadnej zmeny vnútornej energie. Zostal nám teda adiabatický proces.
Pri adiabatickom procese plyn koná prácu na úkor poklesu vnútornej energie (neprijíma ani neodovzdáva žiadne teplo), vďaka čomu poklesne jeho teplota. Zamyslime sa však, či pri našom procese koná plyn prácu. Pri procese, ktorý nastal v Kvíkovej krabici, nebol žiadny piest, na ktorom by mohol plyn konať prácu, resp. nič piestu podobné. Plyn jednoducho iba „vyfučal“ do prázdneho priestoru. Plyn tak nemohol stratiť energiu konaním práce, keďže ju nemal na čom konať! Priznávam, tento argument zatiaľ stojí tak trošku na vode, no pokúsime sa spolu nazrieť trochu hlbšie v nasledujúcom odstavci.
Prečo to nie je adiabatický proces?
Keď má plyn konať prácu prostredníctvom piestu, musí na piest vyvíjať tlak a dodávať mu nejakým spôsobom (zrážkami častíc s piestom) energiu. Ak sa zamyslíme, čo sa deje z mikroskopického pohľadu, častice plynu nesúce hybnosť narážajú na piest. Ten pred nimi uteká. Vďaka tomu majú po odraze od piestu menšiu rýchlosť ako pred odrazom3, a teda stratia časť svojej energie. To je presne tá energia, vďaka ktorej môže piest konať prácu (pri zrážke medzi piestom a časticou si ju odniesol piest).
Túto energiu však stratila častica pri náraze. Strata energie častice sa prejaví ako pokles vnútornej energie plynu, a teda nutne aj teploty4. Keď však nieto piestu ani ničoho jemu podobnému, neexistuje spôsob, ako môžu častice stratiť energiu inak ako nárazom do nejakej inej častice plynu. Častice navyše nepribúdajú, neubúdajú a ani neodchádzajú nikam z krabice alebo do krabice (a teda nemôžu odísť, resp. prísť s energiou takýmto spôsobom). Taktiež energia nemôže utiecť cez steny zrážkami so stenami krabice, keďže tie sú dokonale izolované5. Hľa, energia Kvíkovho plynu v krabici sa teda nezmení!
Tu sa ešte patrí poznamenať, že pracujeme s ideálnym plynom, pre ktorý platí, že jeho častice sa medzi sebou necítia, až na dokonale pružné zrážky, a teda ich celková energia je daná len kinetickou energiou. Keďže nieto potenciálnej energie, energia sa nemôže skryť ani na toto „miesto“. Dochádzame teda k silnejšiemu záveru: celková kinetická energia častíc plynu sa nezmení! A teda nezmení sa ani teplota plynu! Pozor, to neznamená, že proces, ktorý vidíme je izotermický proces v takom zmysle slova, ako sme sa učili v škole. Proces, ktorý nastal v Kvíkovej krabici je zvláštny totiž tým, že sa pri ňom nekoná práca a ani neprijíma či odovzdáva teplo.
Ako je to teda s tým piestom a zrážkami s ním?
Predstavme si ťažký piest hmotnosti \(M\) idúci doprava rýchlosťou \(v\) a ľahkú časticu hmotnosti \(m\), idúcu tiež doprava rýchlosťou \(V > v\). Vzhľadom na piest sa častica teda pohybuje rýchlosťou \(V-v\). Po náraze bude mať v sústave spojenej s piestom rýchlosť \(-(V-v)\) (keďže \(M \gg m\), ide o pružnú zrážku so stenou) a teda vzhľadom na stojacu krabicu rýchlosť \(-(V-v)+v = -V + 2v\)6. Koľko energie stratila častica?
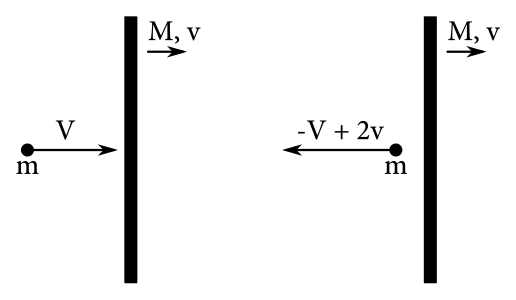
\[ \Delta E = \frac{1}{2}mV^2 - \frac{1}{2}m{\left(-V+2v\right)}^2 = \frac{1}{2}m\left(4vV - v^2\right) > 0 \text{.} \]
Kam zmizla táto energia? Keďže \(M \gg m\), rýchlosť piestu sa prakticky nezmení, keďže hybnosť častice plynu je malá. Napriek tomu si ale odnesie energiu. Takýmto spôsobom teda plyn na mikroskopickej úrovni koná prácu, a stráca svoju vnútornú energiu za to, že koná prácu.
Ako to teda je?
Počet častíc sa nezmení. Objem plynu sa zdvojnásobí. Tlak a teplota musia byť v obidvoch častiach po ustálení rovnaké. Plyn nevykoná žiadnu prácu. Neprijme ani neodovzdá žiadne teplo. Teplota sa nezmení tiež. Ak predpokladáme, že ide o ideálny plyn, na začiatku platila stavová rovnica, \[ pV = nRT\text{.} \] Po ustálení musí platiť tiež7, a preto \[ \begin{aligned} p'V' &= nRT'\text{,}\\ p'2V &= nRT\text{,}\\ p' &= \frac{1}{2}\frac{nRT}{V} = \frac{1}{2}p\text{.} \end{aligned} \]
Plyn bude mať teda stále rovnakú teplotu, ale polovičný tlak.
Pár poznámok nakoniec
Taktiež si môžeme všimnúť, že počas toho, ako sa plyn rozpína do druhej časti krabice, nie je v druhej časti krabice dobre definovaný tlak v okamihu, keď sa už v druhej časti krabice nachádzajú častice, no ešte nenarážajú na jej steny). Takéto procesy, pri ktorých nie je dobre definovaná8 nejaká termodynamická veličina, sa nazývajú nerovnovážne. Pre tie nemožno použiť stavovú rovnicu v okamihu, keď plyn ešte nie je ustálený (t. j. v rovnováhe).
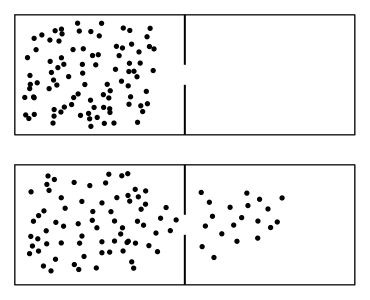
Proces v Kvíkovej krabici je navyše príkladom nevratného procesu. To je proces, v ktorom nevieme nekonečne malými zmenami nejakých veličín dostať postupne plyn cez rovnovážne stavy naspäť do „pôvodného stavu“. Opakom sú vratné procesy, kedy je systém vždy v rovnováhe9. Adiabatický, izotermický, izochorický a izobarický proces sú všetko vratné procesy. Preto má aj zmysel kresliť nejaké im prislúchajúce krivky napr. v p–V diagrame. Príkladom nevratného procesu je napríklad to, čo vidíme tuto, otvorenie voňavky a pod. a všetky ďalšie príklady, pri ktorých ste počuli populárne rozprávky o tom, že sa entropia zvyšuje.
K nej však napokon ešte jedna poznámka. Entropia plynu sa môže meniť aj pri vratných procesoch a aj sa mení, napr. pri izotermickom, izochorickom a izobarickom procese. Pri adiabatickom sa nemení. Ako súvisí entropia s prijatým teplom, vratnosťou a nevratnosťou sa však poriadne dozviete až na vysokej škole. Takže sa netreba báť, že vôbec nerozumiete tomu, čo sa skrýva za týmto populárne znejúcim slovom :)
Komentár k prideleným bodom
Bodovanie bolo tento raz veľmi náročné. Snažil som sa čo najviac zohľadniť logickú konzistentnosť Vašich úvah. Taktiež som veľmi ocenil, ak sa niekto snažil vysvetliť nejako hlbšie prečo sa napríklad teplota nezmení či prečo nakonci musí byť v priemere polovica častíc v jednej časti krabice.
Naopak body som strhával za nekonzistentnosť úvah či prístup typu „Vyber si z tohto správne riešenie“ :) Dobre odôvodnené „adiabatické“ riešenia10 získali typicky viac bodov ako neokomentované riešenia typu „Vyber si, nastane toto alebo toto“, ktoré sa nepokúšali vôbec nič vysvetliť.
Tým Vás chceme motivovať, aby ste sa nebáli rozmýšlať nad úlohami a nebáli sa rozmýšlať nad tým čo píšete v riešeniach, kedy vlastne platia veci, ktoré nás učia v škole, aj keď nám častokrát zamlčia kopec detailov.
Odborne sa tomu hovorí stav termodynamickej rovnováhy.↩
Ak sa pozeráme na krabicu ako celok.↩
Pre neveriacich alebo nedočkavých, nižšie si to spočítame :P↩
Teplota je jednoducho len priemerná energia plynu↩
Teda zrážky so stenami krabice musia byť zo svojej podstaty dokonale pružné.↩
Kto neverí, môže si napísať zákon zachovania hybnosti a energie potom vypočítať rýchlosť častice po odraze. Na konci treba využiť, že \(M \gg m\).↩
Pozor, počas toho ako plyn fučí do druhej polovice stavová rovnica neplatí, pretože nie je dobre definovaný objem plynu a ani jeho tlak. Stavová rovnica totiž platí iba pre rovnovážne stavy, a stav, kedy plyn fučí, nie je rovnovážny. Preto ho ani stavová rovnica nevie popísať. Stavová rovnica však vie správne popísať začiatok a koniec, keďže to už sú rovnovážne stavy.↩
zo štatistického pohľadu↩
T. j. všetky termodynamické veličiny ako tlak, teplota, … sú z makroskopického pohľadu počas celého procesu stále ustálené a dobre definované.↩
Ale postavené ale na zlom predpoklade.↩
Diskusia
Tu môžte voľne diskutovať o riešení, deliť sa o svoje kusy kódu a podobne.
Pre pridávanie komentárov sa musíš prihlásiť.