Zadanie
Po pálení múky a ohadzovaní sa cestom dostali FKSáci ďalší bláznivý nápad na najbližšie letné sústredenie – miešanie octu so sódou. Zmiešame dva decilitre octu s určitým množstvom sódy. Kedy to urobí najväčší neporiadok? No predsa vtedy, keď sa uvoľní čo najviac plynu. Pomôžte FKS vedúcim zistiť,1 aký objem plynu vznikne pri reakcii octu so sódou v závislosti od množstva sódy. Pokúste sa aj teoreticky odhadnúť objem uvoľneného plynu na základe vlastného modelu.
Či experimentálku budete riešiť alebo nie, to, či sa táto hlúposť objaví na ďalšom sústredku, to neovplyvní :)↩
Našou úlohou je zmerať objem uvoľneného plynu pri reakcii nejakého množstva sódy s dvoma decilitrami octu. Poďme sa najprv pozrieť na to, aké reakcie budú v našej sústave prebiehať (lebo teoretický model, pokiaľ máme kapacity na to, aby sme ho spravili, všeobecne vôbec nie je od veci).1
Teória
Obyčajný kuchynský ocot je osempercentným (a podľa údajov na obale sa tým zjavne myslia objemové percentá) vodným roztokom kyseliny octovej. Okrem toho je tam ešte nejaké smiešne množstvo konzervantu a farbiva, ale to môžeme zanedbať. Sóda, teda hydrogénuhličitan sodný bude reagovať s kyselinou octovou, avšak môže reagovať aj s vodou. V našej sústave budú teda prebiehať dve reakcie
\[\mathrm{NaHCO_3(s)+H_2O(l) \longrightarrow Na^+(aq)+H_2O(l)+HCO_3^-(aq)}\text{,}\] \[\mathrm{NaHCO_3(aq)+CH_3COOH(aq) \longrightarrow Na^+(aq)+CH_3COO^-(aq)+H_2O(l)+CO_2(g)}\text{.}\]
V podstate ide o to, že sóda sa rozpustí na ióny a hydrogénuhličitanový anión sa účinkom kyseliny octovej rozkladá na oxid uhličitý a vodu. Ako vidíme, reakcie sú to celkom jednoduché, dokonca ani stechiometrické koeficienty nebudú robiť problémy, keďže sú všetky rovné jednej.
Na to, aby sme z týchto rovníc vedeli niečo rozumné vyrátať, si najprv potrebujeme zistiť zopár konštánt.
- Mólová hmotnosť sódy: \(M(\mathrm{NaHCO_3})=\SI{84.01}{\gram\per\mole}\)
- Mólová hmotnosť kyseliny octovej: \(M(\mathrm{CH_3COOH})=\SI{60.05}{\gram\per\mole}\)
- Mólová hmotnosť vody: \(M(\mathrm{H_2O})=\SI{18.02}{\gram\per\mole}\)
- Mólová hmotnosť oxidu uhličitého: \(M(\mathrm{CO_2})=\SI{44.01}{\gram\per\mole}\)
- Hustota oxidu uhličitého pri a : \(\rho(\mathrm{CO_2})=\SI{1.902e-3}{\gram\per\centi\metre\cubed}\)2
- Hustota kyseliny octovej: \(\rho(\mathrm{CH_3COOH})=\SI{1.049}{\gram\per\centi\metre\cubed}\)
- Hustota vody pri : \(\rho(\mathrm{H_2O})=\SI{0.998}{\gram\per\centi\metre\cubed}\)
Máme obmedzené množstvo octu, to znamená, že existuje nejaké maximálne množstvo sódy, ktoré tam môžeme nasypať, a ktoré ešte bude mať s čím zreagovať. Poďme si to najprv spočítať:
Chemické rovnice prebiehajúcich reakcií nám v podstate hovoria to, že na každý zreagovaný mól kyseliny octovej vznikne jeden mól oxidu uhličitého. Teda platí \[n(\mathrm{CH_3COOH})=n(\mathrm{CO_2})\text{.}\]
Látkové množstvo kyseliny octovej vieme spočítať z údajov o objeme a zložení octu: \[n(\mathrm{CH_3COOH})=\frac{\SI{200}{\centi\metre\cubed} \cdot \num{0.08} \cdot\SI{1.049}{\gram\per\centi\metre\cubed}}{\SI{60.05}{\gram\per\mole}} \doteq \SI{0.28}{\mole}\text{.}\]
Teda maximálne látkové množstvo vzniknutého oxidu uhličitého je . Objem vzniknutého oxidu uhličitého bude teda rovný \[V(\mathrm{CO_2})=\frac{n(\mathrm{CO_2})\cdot M(\mathrm{CO_2})}{\rho(\mathrm{CO_2})}=\frac{\SI{0.28}{\mole} \cdot \SI{44.01}{\gram\per\mole}}{\SI{1.902e-3}{\gram\per\centi\metre\cubed}} \doteq \SI{6479}{\centi\metre\cubed}\text{.}\]
Jeden pohár octu má potenciál viac ako šesť litrov oxidu uhličitého. Na takéto množstvo potrebujeme \(n(\mathrm{CO_2}) \cdot M(\mathrm{NaHCO_3}) = \SI{0.28}{\mole} \cdot \SI{84.01}{\gram\per\mole} \doteq \SI{23.5}{\gram}\) sódy. Teda vieme, že viac sódy tam nemá zmysel sypať. Teraz vyjadríme závislosť objemu oxidu uhličitého od hmotnosti zreagovanej sódy a máme, čo sme chceli:3 \[V(\mathrm{CO_2})=\frac{\frac{m(\mathrm{NaHCO_3})}{M(\mathrm{NaHCO_3})}\cdot M(\mathrm{CO_2})}{\rho(\mathrm{CO_2})} \doteq m(\mathrm{NaHCO_3}) \cdot \SI{275}{\centi\metre\cubed\per\gram}\]
Na každý gram sódy sa nám majú uvoľniť takmer tri deci oxidu uhličitého.
Meranie
Tak a teraz k meraniu4. Spôsobov ako to merať je viacero, my uvedieme jeden z nich.
Použili sme fľašu naplnenú vodou obrátenú hore dnom vo vedre s vodou, do ktorej sme zaviedli hadičku z fľaše, v ktorej by mala prebiehať reakcia. Pri tejto metóde si treba dať pozor na vzduchotesnosť aparatúry, čo môže byť v domácich podmienkach trochu ošemetné, ale všetko sa dá vyriešiť.5 V reakčnej fľaši sme zmiešali dva decilitre octu s daným množstvom sódy, rýchlo fľašu zavreli vzduchotesným uzáverom s hadicou a sledovali, ako oxid uhličitý buble do fľaše vo vedre, kým reakcia neprestala bežať. V tomto kroku sme museli byť trpezliví a reakčnú zmes občas aj trochu pomiešať. Potom sme vyrovnali hladiny vody vo vedre a v ponorenej fľaši, čím sme vyrovnali tlaky. Keby sme tak neurobili, plyn by zostal stlačený a celé meranie by sme tým pokazili. Zaujíma nás predsa objem pri atmosferickom tlaku. Vytiahli sme fľašu tak, aby z nej nevytiekla voda a odmerali sme, aký objem vody treba doliať do fľaše (teda aký objem vody nám oxid uhličitý vytlačil). To sa dalo urobiť napríklad tak, že odvážime fľašu po meraní a fľašu plnú vody.


Meranie sme spravili pre desať rôznych hmotností sódy. Samozrejme, meranie pre každú hmotnosť sa patrí viackrát zopakovať, aby sme získali presnejšie výsledky. My sme tak neurobili, ale dúfame, že vy áno ;) Výsledky sme spracovali v softvéri OriginLab. Existuje kopa ďalších, Excel, Calc, Gnuplot… Môžete si vybrať.
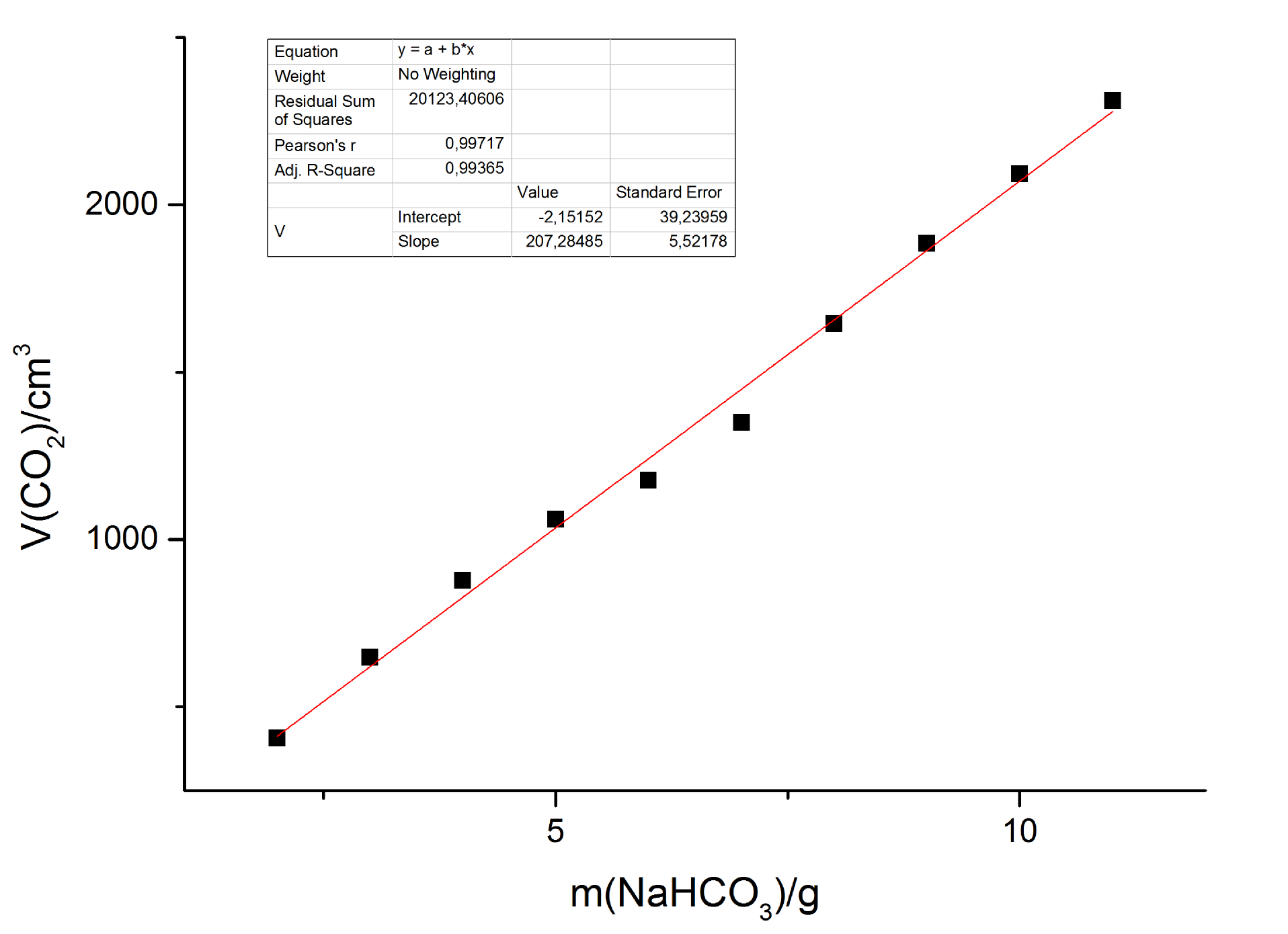
Vidíme, že merania sa správajú približne podľa nášho teoretického modelu. Keby sme mali desaťlitrovú fľašu, tak by sme videli, že od sódy by sa už objem nezvyšoval.
Na záver, ako zvyčajne, sa treba zamyslieť nad zdrojmi nepresností merania. Meranou veličinou bola hmotnosť, ktorá k chybe merania veľmi neprispieva, ak hovoríme o meraní hmotnosti fľaše pred a po pokuse. Avšak pri meraní hmotnosti sódy pred nasypaním do reakčnej fľaše môže byť rozdiel signifikantný, nakoľko naša váha meria s presnosťou na a hmotnosť použitej sódy pri jednotlivých meraniach je tiež rádovo v gramoch, pričom veľké množstvá sódy by ani nemalo zmysel používať, lebo by celá nezreagovala.
Ďalším veľkým zdrojom nepresností je únik vzniknutého plynu. Či chceme, či nie, sódu musíme do octu nejako nasypať, teda je potrebná interakcia zvonka a až potom sa môže reakčná sústava uzavrieť (aj tak je vysoko možné, že v domácich podmienkach sústava veľmi vzduchotesná nebude). Bohužiaľ, práve na začiatku reakcie je jej rýchlosť najväčšia a vznikne naraz najviac oxidu uhličitého, teda nám určite nejaký stihne uniknúť, kým sústavu uzavrieme.
Potom sa ešte môže stať, že pri vyťahovaní fľaše z vedra po skončení reakcie sa z nej vyleje nejaká tá voda, resp. zanedbávame objem hadice vo fľaši.
To by bolo asi tak všetko. Čo sa toho najväčšieho bordelu týka, veľmi mu napomáha aj rýchlosť reakcie. Čím vyššia, tým lepšie. Teda keď chceme mať celú kuchyňu od octu, treba sa uistiť, že maximalizujeme povrchový kontakt sódy s octom. Pomôže napríklad to, že sypeme sódu do octu a nie naopak, a snažíme sa sódu čo najviac rozprášiť. Keď k tomu pridáme veľa sódy naraz, výsledkom je poriadny bordel a niekoľkohodinová čuchová apokalypsa.
Samozrejme, nevyžadovali sme to takto presne od vás, stačilo spraviť zopár odhadov.↩
Použila som obyčajný izbový barometer, teplomer a http://www.peacesoftware.de/einigewerte/co2_e.html↩
Z chemických rovníc je zrejmé, že podobne ako pre kyselinu octovú aj pre sódu platí, že na každý mól sódy sa uvoľní jeden mól oxidu uhličitého, teda látkové množstvo dodanej sódy je rovné látkovému množstvu uvoľneného oxidu uhličitého. Platia vzťahy: \[V(\mathrm{CO_2})=\frac{n(\mathrm{CO_2})\cdot M(\mathrm{CO_2})}{\rho(\mathrm{CO_2})}\text{,}\] \[n(\mathrm{CO_2})=n(\mathrm{NaHCO_3})=\frac{m(\mathrm{NaHCO_3})}{M(\mathrm{NaHCO_3})}\text{.}\]↩
To je to, čo sme od vás už vyžadovali poriadne.↩
Múdrosti starej matere kapitola 1. – domáce destilačky sa vždy izolovali cestom.↩
Diskusia
Tu môžte voľne diskutovať o riešení, deliť sa o svoje kusy kódu a podobne.
Pre pridávanie komentárov sa musíš prihlásiť.